Biosens. Bioelectron. | 基于金纳米粒子SPR效应的免扩增CRISPR系统实现HPV基因分型
近日,马英新课题组在Biosensors and Bioelectronics上发表了题为《Amplification-free CRISPR/Cas12a biosensor integrating AuNPs-mediated surface plasmon resonance for human papillomavirus detection and genotyping》的文章。该研究提出了一种创新的免扩增、床旁高危人乳头瘤病毒(hrHPV)基因分型检测平台。该平台结合了CRISPR/Cas12a技术与碱性磷酸酶(ALP)介导的表面等离子体效应(SPR)信号放大策略。其检测原理基于:Cas12a-crRNA复合物识别靶标HPV DNA后,其反式切割活性被激活,能够切割微孔内修饰的ALP标记寡核苷酸探针,从而释放出ALP。释放的ALP催化对氨基苯基磷酸盐(p-APP)水解生成对氨基苯酚(p-AP)。p-AP分子触发纳米金颗粒(AuNP)表面发生聚集,最终导致其表面等离子体共振吸收峰发生变化。这种光学变化即为可检测的输出信号。与传统的基于Cas12a反式切割活性结合ALP水解对硝基苯基磷酸盐(p-NPP)比色检测方法相比,本研究所采用的ALP/CRISPR-Cas12a整合策略将检测灵敏度提升了10,000倍,HPV DNA检测限(LOD)低至300 aM。此外,通过结合微孔板空间分离设计,该平台能够在2.5小时内特异性筛查九价HPV疫苗所涵盖的九种HPV亚型。利用宫颈拭子样本进行性能验证,结果证实了其HPV基因分型能力的高度准确性。综上,该策略为多重核酸靶标检测提供了一种无需预扩增、免仪器且操作简便、便携、成本效益高的解决方案。
自CRISPR系统具备靶向并切割特定核酸的能力被发现以来,基于成簇规律间隔短回文重复序列(CRISPR)的检测系统已成为一种功能强大的诊断工具。CRISPR相关蛋白(Cas),包括Cas12, Cas13, and Cas14, 因其具有反式切割活性——即在识别靶标后可切割邻近的非靶标核酸——已被应用于分子诊断领域。多种CRISPR检测方法(如SHERLOCK、DETECTR和HOLMES)通过整合重组酶聚合酶扩增(RPA)或聚合酶链式反应(PCR)等预扩增技术,实现了高灵敏度与便携性。然而,这些方法依赖扩增步骤,增加了气溶胶污染的风险,同时延长了检测时间。为应对上述挑战,研究人员已开发出多种免扩增CRISPR/Cas检测策略,包括:电化学发光法、石墨烯场效应晶体管法、表面等离子体共振(SPR)法、数字微流控系统、表面增强拉曼散射(SERS)法以及多重crRNA组合策略。这些方法通过省去耗时且依赖设备的扩增过程,实现了快速、便携且低成本的检测,特别适用于资源匮乏环境中的即时检测(POCT)应用。然而,仍需要进一步的改进这些免扩增CRISPR/Cas检测系统,使得它们能够应用于多种DNA靶标检测。
人乳头瘤病毒(HPV)包含200多种基因上不同的变异型,是全球公共卫生的重大挑战。大约有40种亚型表现出对肛生殖器和口咽上皮的嗜性,其中14种高危型已被世界卫生组织(WHO)归类为致癌型。作为全球最常见的性传播感染,超过80%的成年人在其一生中至少感染过一种HPV亚型。尽管细胞介导的免疫反应可在两年内清除90%的感染,但持续的高危型HPV感染可能导致癌前病变甚至癌症的发生。HPV检测可直接识别病毒,有助于在癌前病变出现前实施早期干预,是预防性医疗保健的基石,为降低HPV相关疾病风险提供了可靠且有效的手段。将HPV检测纳入全球筛查项目具有挽救大量生命的潜力,突显了其在癌症预防中的关键作用。目前已有多种HPV检测技术被开发出来,包括DNA微阵列技术、实时定量PCR(qPCR)、反向线印迹杂交技术、Sanger测序及下一代测序(NGS)等。这些技术具备高灵敏度和高通量特性,但也存在一些局限性,例如交叉污染风险、成本较高、检测周期长以及引物设计复杂等技术挑战。尽管如此,优化后的HPV检测在资源有限地区尤为重要,是实现全球消除宫颈癌目标进程中的关键环节。
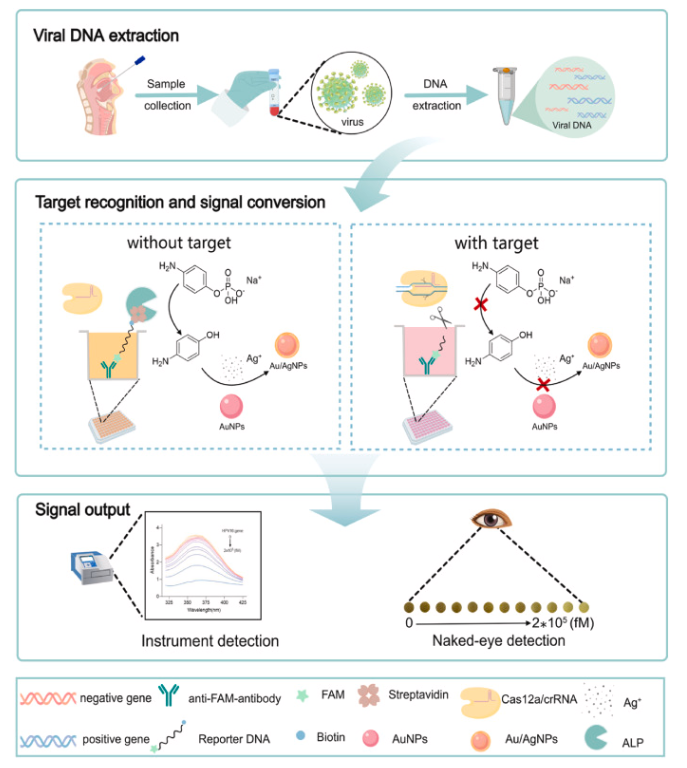
流程图1. ALP介导的CRISPR/Cas12a生物传感平台用于病毒DNA检测的示意流程图。
本研究提出了一种新型的碱性磷酸酶(ALP)整合CRISPR/Cas12a诊断平台,用于高精度HPV基因分型。该系统采用双酶信号放大策略,将Cas12a反式切割活性与ALP介导的金纳米颗粒(AuNP)的SPR效应整合,以提高检测灵敏度(流程图1)。通过寡核苷酸偶联将ALP固定在微孔上,随后通过激活的Cas12a切割ssDNA释放ALP,建立靶向响应信号转导通路。ALP催化水解诱导AuNPs聚集以及Au/Ag NPs的生成,通过SPR效应进一步放大信号。这种免扩增的CRISPR方法灵敏度高(300 μM的检测极限),符合临床检测的需求。该平台可精确靶向对应于九种HPV亚型的HPV L1基因,能特异性区分病毒亚型,使用该方法对宫颈拭子样本进行检测,结果与标准PCR完全一致。该平台的卓越性能源于四项关键创新:1) Cas酶信号放大与纳米颗粒等离子体效应的协同整合:实现高灵敏度检测;2) 微孔板反应室的空间隔离技术:保障精确的基因分型;3) 高信号强度设计:无需核酸预扩增步骤;4) 碱性磷酸酶(ALP)介导的显色反应:提供直观的视觉检测性能。该平台兼具试剂消耗低和结果可视化等优势,极其适合基层医疗机构开展宫颈癌筛查的即时检测(POCT)。研究证实,该技术不仅能显著增强全球HPV监测能力,还为构建多重病原体通用检测平台奠定了框架基础。
此前,研究人员已经利用碱性磷酸酶产生氨基苯酚,并作为还原剂还原银离子,开发了一系列的生物传感器。如Shaban等人构建了一种基于对氨基苯酚介导的银纳米颗粒生长的比色ALP生物传感器。Zhang等人开发了一种利用金纳米棒表面银沉积的多波长免疫测定法,用于灵敏地检测芴。我们系统地研究了采用金纳米颗粒(AuNPs)的ALP催化表面等离子体共振(SPR)调制作为超灵敏信号报告子的可行性。该反应过程主要包括两个关键步骤:首先,碱性磷酸酶(ALP)催化对氨基苯基磷酸盐(p-APP)水解,生成对氨基苯酚(p-AP)和无机磷酸;随后,生成的p-AP可进一步还原银离子(Ag⁺),并在金纳米粒子表面控制性沉积金属银(Ag⁰),从而形成具有调控SPR性质的金/银双金属纳米结构。ALP介导的SPR响应及金/银双金属纳米粒子形成的光学变化分析如图1A所示。此外,本研究采用TEM、动态光散射(DLS)和紫外可见吸收光谱等多种分析技术对AuNP和Au/AgNP进行了全面表征。TEM图像显示AuNP分散良好,粒径分布较窄(13.96 ± 4.793 nm)在ALP介导的金属化之后,Au/AgNP的形成是明显的,伴随着特征性的形态变化和聚集(图1C)。为了进一步证实Ag⁰在AuNP表面上的沉积,我们进行DLS分析以测量AuNP和通过ALP催化产生的Au/AgNP的流体动力学直径和ζ电位。如图1D所示,AuNP的流体动力学直径为约57.07 nm,而Au/AgNP的流体动力学直径显著增加至1028 nm。此外,AuNP和Au/AgNP的ζ电位值分别为-46.13 mV和-31.90 mV。流体动力学直径和ζ电位的增加证实ALP介导的酶催化金属化反应。此外,如图S2所示,反应后溶液中颗粒的元素分析结果显示,金(Au)元素和银(Ag)元素分别占10%和90%,进一步证明了Au/AgNP中Ag元素的存在。
ALP介导的SPR效应可实现ALP的定量检测。如图1 E所示,合成的AuNP在520 nm处显示出特征吸收峰,而Au/AgNP在370 nm处显示出明显的蓝移峰。这是AuNP表面Ag⁰沉积导致的光谱位移,证实了Au/AgNP的形成。此外,等离子体响应具备ALP浓度依赖性。如图1F显示,随着ALP浓度的增加,Au/AgNP在370 nm处的吸光度逐渐增加。这种浓度依赖性SPR效应使得系统通过等离子体信号放大实现亚皮摩尔水平ALP超灵敏检测。
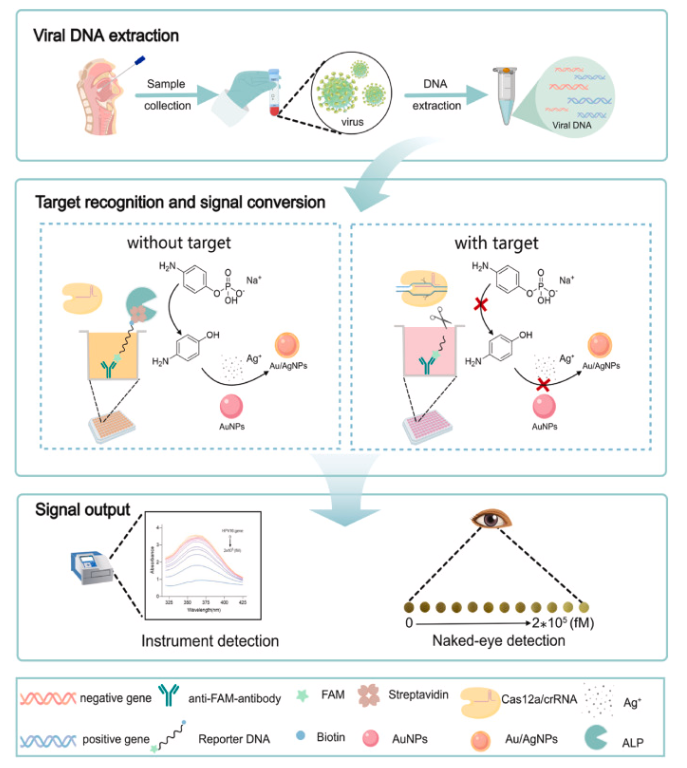
图1. ALP介导AuNP表面沉积Ag⁰进而形成Au/AgNP
