Science Advances丨深圳先进院脑所/深港脑院周涛团队合作揭示RNA m6A调控核糖体生成通路参与大脑发育的新机制
大脑发育是一个复杂且受到精确调控的过程,涉及神经干细胞的增殖和分化等关键步骤。发育异常会导致严重的神经发育障碍疾病,如小头畸形(microcephaly),给患者、家庭和社会带来沉重负担。在大脑发育过程中,神经干细胞增殖需要活跃的核糖体生成以满足大量蛋白合成的需求。核糖体生成是高度协调且耗能的过程,涉及一系列核糖体RNA(rRNA)加工因子和核糖体组装分子的协调参与。已有研究表明,核糖体生成缺陷与小头畸形等大脑发育缺陷存在关联,而增强的核糖体生成则与癌症发生密切相关。因此,精确调控核糖体生成对于正常发育和癌症预防都至关重要。然而,目前对于核糖体生成的RNA表观遗传调控机制尚不清楚。
6月28日,中国科学院深圳先进技术研究院(简称“深圳先进院”)脑认知与脑疾病研究所/深港脑科学创新研究院周涛研究员团队与南京医科大学沈彬教授团队在Science Advances发表题为“VIRMA-mediated m6A modification regulates forebrain formation through modulating ribosome biogenesis”的研究论文,首次揭示m6A甲基转移酶复合物的核心支架蛋白VIRMA通过调控核糖体生成影响大脑发育的机制。

文章上线截图
N6-甲基腺嘌呤(m6A)修饰作为真核生物中广泛存在的转录后调控机制,其动态可逆的特性由甲基转移酶复合物(也称为m6A “writer”,包括METTl3、METTL14、WTAP和VIRMA等)和去甲基化酶(也称为m6A “eraser”)共同调控,并通过m6A识别蛋白(也称为m6A “reader”)影响RNA的代谢与功能。2011年芝加哥大学何川教授团队发现首个去甲基化酶FTO,揭示m6A具有动态可逆特性,开启了RNA表观遗传学研究热潮。虽然m6A修饰与胚胎期大脑发育的研究国内外均有,例如条件性敲除甲基转移酶复合物催化组分METTL3或METTL14都会导致脑发育缺陷,然而这些研究在分子机制方面存在很大差异,具体机制亟待统一。
作为甲基转移酶复合物中最大且进化上最新的组分,VIRMA具有独特的结构和功能特征。结构学研究表明,VIRMA呈现特征性"horse-shaped"构象,与WTAP共同构成复合物结构核心。特别值得注意的是,甲基转移酶复合物中的四个RNA结合位点中有三个位于VIRMA,这使其在底物识别中起关键作用。本研究首次以VIRMA为切入点,通过构建条件性基因敲除小鼠和神经干细胞模型,结合多种生化分析手段及多组学测序(m6A-seq、RNA-seq、Proteomic等)技术,发现:
1. 核心支架作用:VIRMA作为m6A甲基转移酶复合物的核心支架蛋白,其缺失导致整个复合物不稳定,使mRNA上m6A修饰水平降低60%,破坏mRNA代谢稳态(图1);
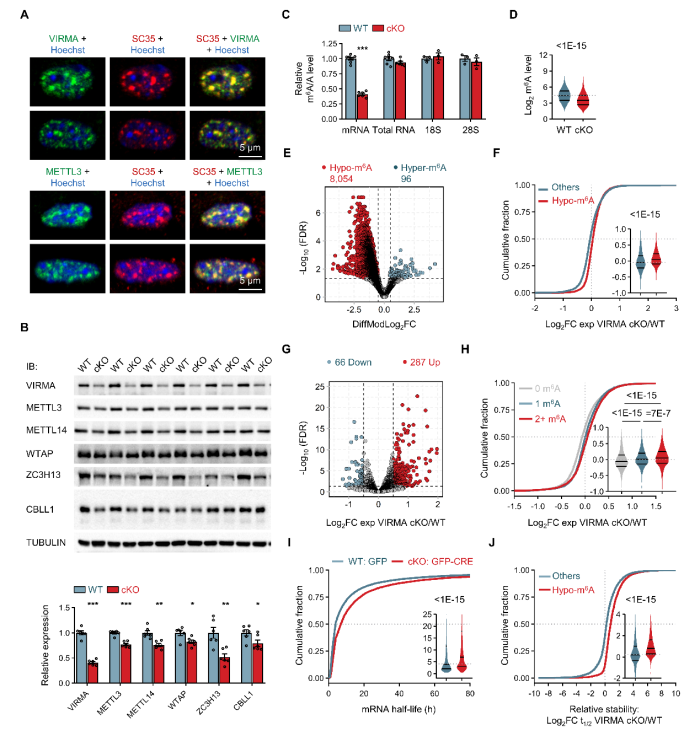
图1. VIRMA缺失导致mRNA的m6A修饰水平降低并破坏mRNA代谢稳态
2. 核糖体生成失调:m6A修饰减少延长了核糖体生成关键因子(如RPP38、NCL等)的mRNA半衰期,导致mRNA异常积累,蛋白表达异常升高,反而引起核糖体生成缺陷和蛋白翻译显著抑制(图2);
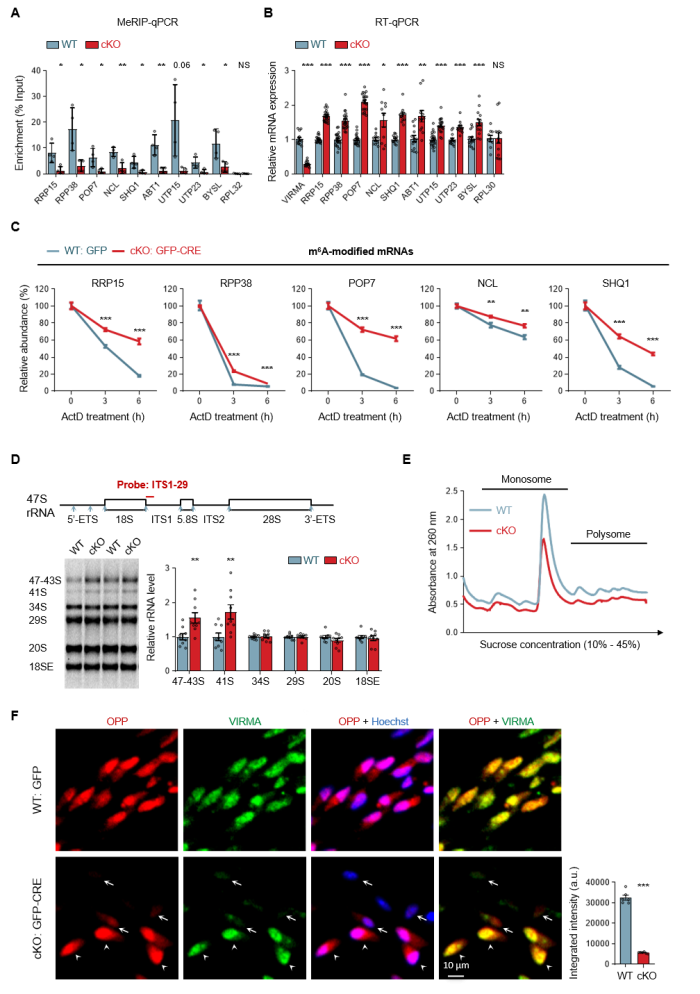
图2. VIRMA缺失通过延长核糖体生成关键因子mRNA半衰期引发核糖体生成缺陷与全局蛋白翻译抑制
3. 发育危机:核糖体生成缺陷触发p53依赖的核仁应激反应,抑制p53蛋白降解,细胞内p53过度积累与激活,导致细胞周期停滞和凋亡,引发大脑结构异常(图3)。
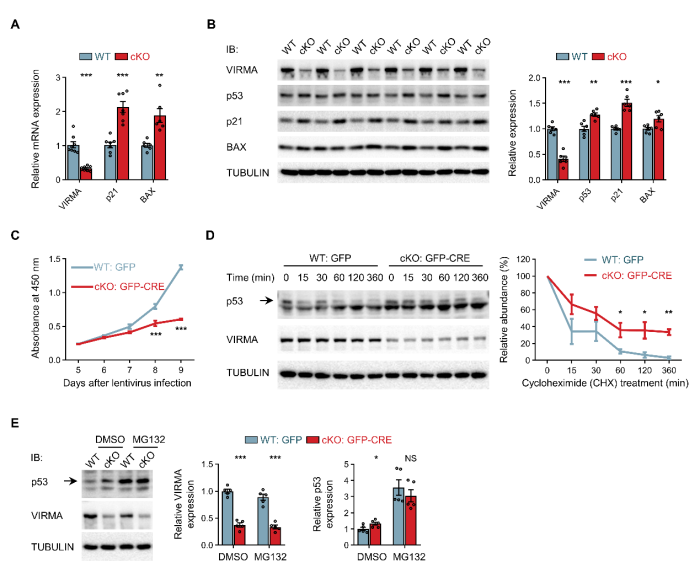
图3. VIRMA缺失通过p53依赖的核仁应激反应引发细胞周期停滞与凋亡
综上所述,该研究阐明了VIRMA-m6A-核糖体轴调控大脑发育的分子机制(图4),为理解小头畸形等神经发育疾病提供了新视角。此外,该研究还初步发现VIRMA在乳腺癌细胞(MCF7)和宫颈癌细胞(HeLa)中同样调控核糖体合成,提示其作为潜在治疗靶点的价值。
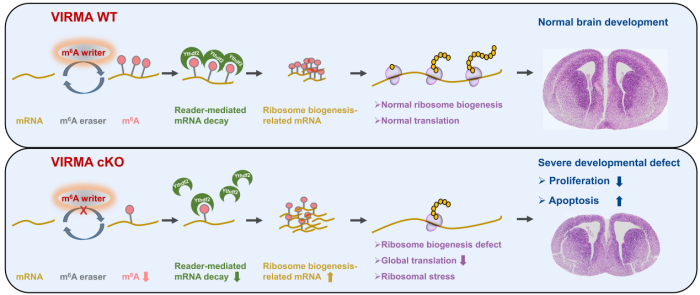
图4. VIRMA介导的m6A修饰调控核糖体生成通路参与大脑发育的分子机制示意图
深圳先进院为论文第一单位;深圳先进院周涛研究员、吴敏助理研究员和南京医科大学沈彬教授为该论文的共同通讯作者;深圳先进院助理研究员吴敏、博士生吴晓丽(现为深圳先进院博士后)和南京医科大学的博士生孙海峰(现为耶鲁大学博士后)为论文的共同第一作者。该研究在科技部国家重点研发计划、国家自然科学基金、广东省基础与应用基础研究基金和深圳市科技创新计划等经费的资助下完成。周涛研究员已于近期加入深圳理工大学生命健康学院。
